

发布时间:2018-01-12
1月12日,《细胞研究》期刊在线发表了题为《运用CRISPR/Cas9编辑技术获得基因敲入食蟹猴》的研究论文,该研究由中科院神经科学研究所、脑科学与智能技术卓越创新中心、神经科学国家重点实验室杨辉研究组与苏州非人灵长类研究平台孙强团队合作完成。该研究利用了一种以同源臂介导的末端接合(Homology-Mediated End Joining, HMEJ)为基础的基因敲入策略在世界上首次获得了基因敲入的食蟹猴。
由于基因修饰猴模型可以用于模拟人类疾病症状,因此它可以作为研究人类疾病机制和推进临床治疗的工具。然而, 由于普通猴具有繁殖周期长(5 - 6年一代),幼仔数量少(每胎一只)以及基因编辑效率低等特点,导致构建靶向基因编辑猴具有很大的困难和挑战性。最近的一些研究表明,CRISPR / Cas9系统可以用于构建基因敲除猴。然而,与基因敲除相反,由于种种原因例如效率低,到目前为止仍然还没有基因成功敲入猴的报道。
基于实验室之前的研究,同源臂介导的末端接合(HMEJ)的方法可以有效地在猕猴胚胎上实现高效的靶向基因整合。研究人员进一步优化受精卵注入条件,包括供体质粒浓度以及注射剂量,期望在提高敲入效率的同时保持正常的胚胎发育,进而获得基因敲入的猴子。具体来说,
研究人员在Actb (β-actin) 位点插入p2A-mCherry以实现mCherry在Actb启动子的控制下表达。在经历完整的怀孕周期后,研究人员成功地获得了一对双胞胎猴(#1,雄;#2,雌)和三只单胎的雌性猴 (# 3、# 4和# 5)。通过直接表皮荧光观察两只新生猴(# 1,# 5)的脚趾发现,与野生型相比,# 1和# 5展现出mCherry荧光(图A)。对两只死亡雌猴子(# 2,# 3)的各个组织进行切片观察,发现尾巴、脚趾、心脏、肌肉、心脏、肾、大脑和卵巢均显示出不同嵌合程度的mCherry表达。值得注意的是,研究人员在卵巢的大部分区域都检测到mCherry的表达,说明基因敲入猴子具有生殖系传递的可能性(图 B)。所有组织的PCR鉴定测序结果都表明在5’和3’连接处的整合是正确的。此外,Southern印迹分析进一步证实# 2和# 3猴的基因整合是正确的且没有额外的基因随机整合(图C)。
综上所述,研究人员利用CRISPR / Cas9介导的HMEJ策略,通过一细胞胚胎注射首次成功地获得了基因靶向整合的食蟹猴。基于其强大的DNA敲入效率和高保真性,HMEJ介导的敲入策略为构建靶向基因修饰的猴模型提供了可能性。
该项工作由助理研究员姚璇、博士后刘真与研究生王兴在灵长类疾病模型研究组杨辉研究员与苏州非人灵长类研究平台主任孙强博士的指导下完成。
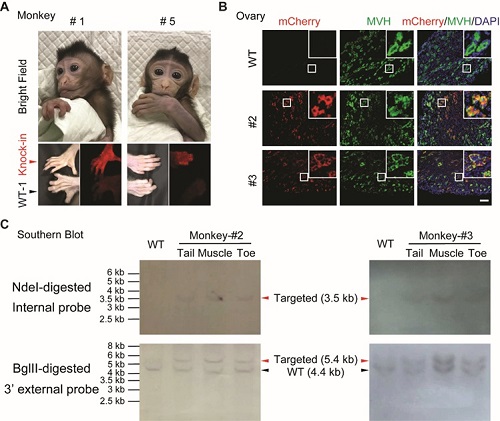
图注:用HMEJ策略获得Actb位点p2A-mCherry基因敲入猴。(A)基因敲入食蟹猴幼仔。上部分,两只(1#和5#)存活幼仔的照片;下部分,两只(1#和5#)存活幼仔脚趾的荧光照片。红色箭头指示基因敲入猴的脚趾,黑色箭头指示野生型猴的脚趾。图片是从年龄相似的猴采集的:1#,5#和WT-1年龄都是大约1个月。(B)两只死亡猴卵巢组织切片的mCherry和MVH的代表性荧光图片。MVH,原始精细胞的标记分子。插入图,高放大倍数图。蓝色,DAPI;绿色,MVH;红色,mCherry。标尺,100μm。(C)Southern Blot 印迹杂交分析。NdeI酶消化和BglII酶消化的2#和3#猴子的基因组DNA分别用内部mCherry探针和3’ 外部探针进行杂交。内部mCherry探针期望的片段大小:野生型=无条带,基因整合=3.5 Kb。3’ 外部探针期望的片段大小:野生型=4.4 Kb,基因整合=5.4 Kb。
 附件下载:
附件下载: 