

发布时间:2022-09-02
神经元细胞与胶质细胞是神经系统最主要的两个细胞分类。在神经发育过程中,神经元类型先产生(“神经发生”,neurogenesis),胶质细胞后产生(“胶质发生”,gliogenesis),展现出高度保守的时序性。然而,从神经发生向胶质发生的切换机制迄今尚未解决,是神经发育研究领域一个基础性问题。
2022年 9 月 1日,《EMBO Reports》期刊以长文形式在线发表了题为《Jag2b-Notch3/1b-mediated neuron-to-glia crosstalk controls retinal gliogenesis》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、上海脑科学与类脑研究中心何杰研究组独立完成。该研究以斑马鱼视网膜为模型,揭示了晚期产生神经元类型与胶质细胞互作参与神经发生向胶质发生切换的新机制。
过去研究表明:Notch信号通路激活对于视网膜穆勒胶质细胞(MG)产生是必要的。在该项目中,研究人员首先分析了Notch信号通路激活水平随着视网膜前体细胞产生穆勒胶质细胞谱系演进中的动态变化。结果显示:单个视网膜前体细胞通过非对称分裂产生一个Notch水平高的新生穆勒胶质细胞和Notch水平低的新生双极细胞(BP,图1所示)。有趣的是,新生穆勒胶质细胞Notch水平随着分化成熟而下降。
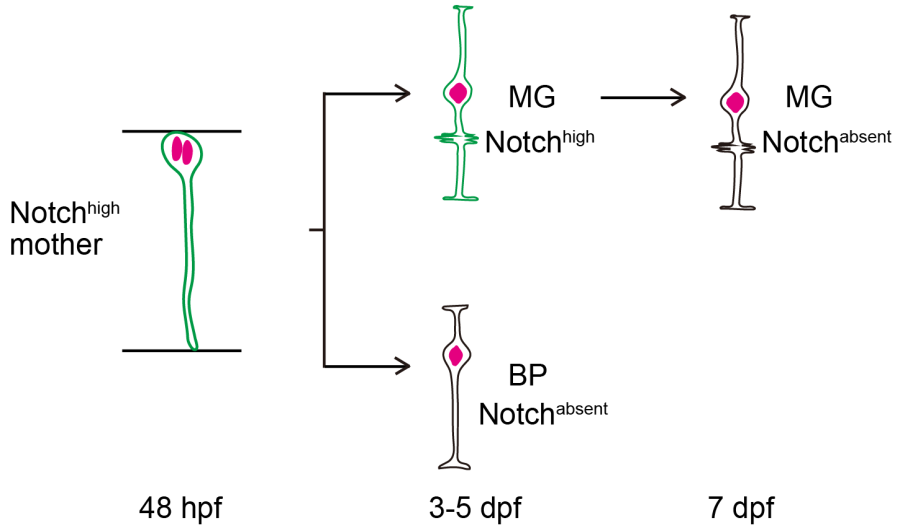
图 1 Notch信号在视网膜穆勒胶质细胞(MG)发育谱系中的动态变化。48 hpf的前体细胞中Notch信号激活高表达,非对称分裂产生一个新生穆勒胶质细胞(MG, 高Notch)和一个姐妹双极细胞(BP, 无Notch)。 随着穆勒胶质细胞的分化成熟,其Notch水平迅速衰退。
进而,研究人员构建了视网膜发育过程中有表达的6个Notch配体和3个Notch受体基因敲除鱼系。结果显示: Notch配体Jag2b与Notch受体Notch3/1b是视网膜穆勒细胞产生所必要的 (图2A)。 Jag2b的缺失会导致原本要形成穆勒细胞的命运转向双极细胞(图2B)。
随后,研究人员结合10x单细胞测序,基因原位杂交和jag2b基因敲入鱼系等多种研究手段,惊奇地发现:jag2b表达于视网膜感光细胞及其前体细胞(图2A)。利用视网膜感光细胞特异性表达基因crx的启动子驱动的jag2b表达能够挽救jag2b-/-突变视网膜穆勒胶质细胞缺失的表型。考虑到感光细胞是属于最晚产生的视网膜神经元类型之一,该研究揭示了感光细胞通过Jag2b/Notch3/1b与新生胶质细胞互作,从而确保穆勒胶质细胞命运选择,同时抑制双极神经元命运选择 (图2B)。
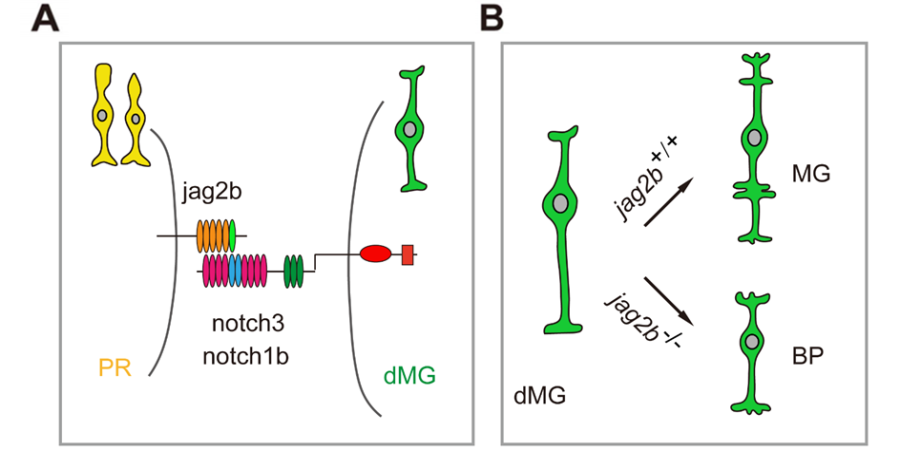
图2 Jag2b-Notch3/1b 介导神经元与胶质细胞的互作调控视网膜胶质细胞产生。(A)Notch信号通路在视网膜中的表达示意图。Notch配体Jag2b 在光感受器及其前体细胞(PR)中特异性表达,Notch3/1b 在分化的胶质细胞(dMG)中特异性表达。(B)Jag2b介导视网膜穆勒细胞的产生机制示意图。在jag2b+/+情况下,分化的胶质细胞产生穆勒胶质细胞;而在jag2b-/-突变体中,分化的胶质细胞产生双极神经元。
中科院脑智卓越中心何杰研究员为该论文的通讯作者;脑智卓越中心博士研究生金梦梦和博士后张慧为该论文共同第一作者,博士研究生徐佰杰,李亚男,秦慧雯, 喻曙光对课题做出了重要贡献。中科院脑智卓越中心分子细胞技术平台予以本项目有力支持。该研究得到科技部、中国科学院、国家自然基金委员会和上海市的支持。
 附件下载:
附件下载: 