

发布时间:2022-08-09
2022年8月9日,《National Science Review》期刊在线发表了题为《内毛细胞发育和转分化依赖Tbx2》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、上海脑科学与类脑研究中心刘志勇研究组完成。该研究揭示了转录因子Tbx2在耳蜗新生和成年内毛细胞 (inner hair cell, IHC)命运决定和转分化中发挥重要功能;同时研究人员利用Tbx2与Atoh1共同异位表达,成功地将新生小鼠耳蜗支持细胞转分化为表达功能蛋白vGlut3的内毛细胞 (或类IHC),为感音性耳聋的临床治疗提供了新的理论基础。
内毛细胞位于耳蜗听觉上皮(又称柯蒂氏器)内侧,负责把声音信号转变为电信号,并传递到螺旋神经节。因此,内毛细胞的先天发育异常和后天损伤均会引起严重的听力障碍。目前听觉领域内有三个重要问题尚未解决:1)内毛细胞是如何分化成熟的?2)成熟内毛细胞的细胞命运是如何维持的?3)能否将耳蜗支持细胞转变为成熟的、有功能的内毛细胞?
为了回答上述三个核心问题,本项目研究人员首先利用单细胞转录组测序技术鉴定出Tbx2是一个在内毛细胞,而不在外毛细胞 (outer hair cell, OHC)表达的转录因子, 并在蛋白水平进行耳蜗不同发育时期的原位验证 (图1A-E)。为进一步研究Tbx2在内毛细胞中的正常生理功能,研究人员构建了Tbx2条件性基因敲除小鼠,发现内毛细胞在缺失Tbx2后,下调其功能蛋白基因vGlut3, 并开始额外表达外毛细胞特异基因Prestin (图1F-G)。另外,野生型和Tbx2 -/- IHC之间的单细胞转录组分析发现Tbx2 -/- IHC分别有862和442个基因显著上调和下调,其中上调的主要包括外毛细胞基因,而下调表达的则主要为内毛细胞基因。该结果进一步证明Tbx2是调控内毛细胞正常分化的核心基因,缺失Tbx2后内毛细胞将不能进行正常分化,反而命运转变为外毛细胞。因此,Tbx2 -/- IHC也被称作induced OHCs (iOHCs)。Tbx2基因不仅在新生内毛细胞表达,而且其表达水平在成年内毛细胞保持稳定 (图1D-E)。研究人员发现在成年小鼠成熟内毛细胞内敲除Tbx2后,可以诱导出类似的命运转变表型。因此,Tbx2不仅调控内毛细胞分化,而且也是维持成年内毛细胞细胞命运的关键基因。
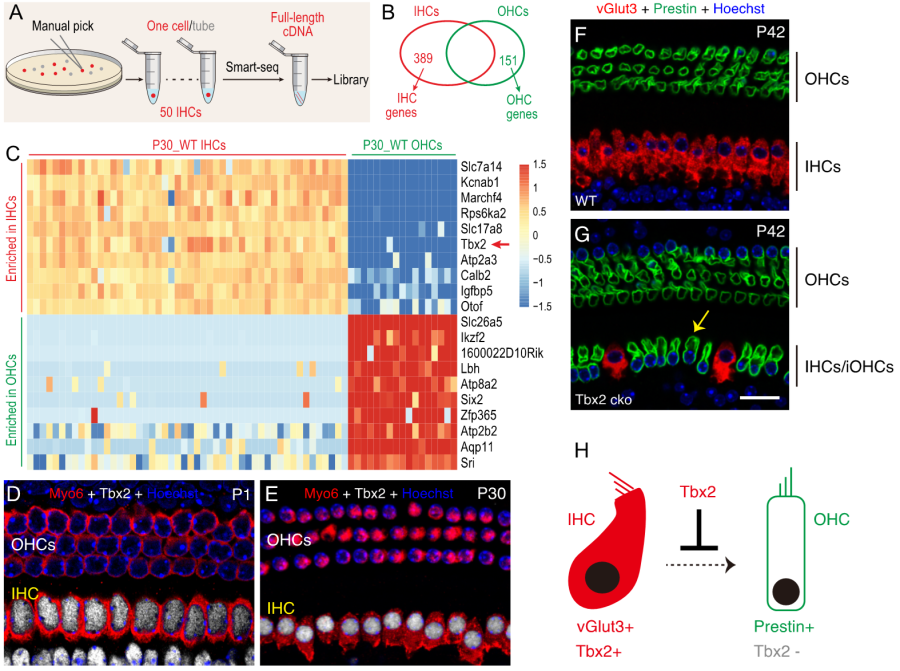
图1. IHC缺失Tbx2后转变为iOHC。(A-C) 单细胞转录组分析显示转录因子Tbx2表达在IHC,但不表达在OHC。(D-E)Tbx2蛋白(白色)在新生(P1)和成年(P30)均表达在IHC,但不表达在OHC。(F-G) IHC在敲除Tbx2后(黄色箭头),vGlut3表达下调,同时Prestin表达上调。(H)Tbx2调控和维持IHC细胞命运的模式图。
非哺乳类动物如鸟类、鱼类在听觉毛细胞损伤后,其支持细胞可以迅速上调Atoh1, 再生出新的毛细胞从而完成听力修复。但是哺乳类动物丧失了这个再生能力。刘志勇研究组构建了一种新的小鼠模型 (图2A),可以实现在耳蜗支持细胞内特异表达Tbx2和Atoh1,并以29.5%的重编程效率将其成功转分化表达功能蛋白vGlut3的内毛细胞(图2B-C)。扫描电镜分析也显示新生内毛细胞具有和野生型内毛细胞类似的纤毛分布特征 (图2D-E)。该研究结果显示Tbx2和Atoh1联用产生的新生内毛细胞无论在数量上,还是在分化程度上,都较之前单独Atoh1过表达有显著的提高。简而言之,该研究推动了哺乳动物耳蜗内毛细胞再生研究领域的进展,为内毛细胞损伤引起的耳聋治疗提供了新途径。
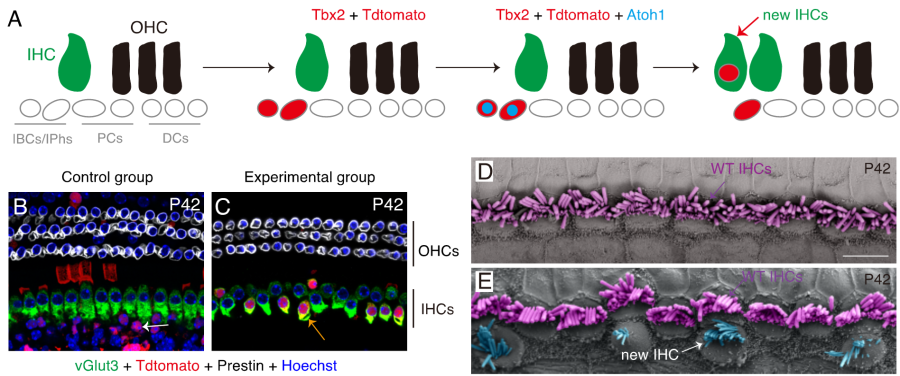
图2 Tbx2和Atoh1转分化耳蜗支持细胞为vGlut3+的IHC。(A)新生小鼠耳蜗支持细胞转分化为IHCs的示意图。(B)对照组小鼠耳蜗支持细胞(主要是IBCs/IPhs)只表达红色荧光蛋白,但不表达内毛细胞功能蛋白vGlut3 (白色箭头)。(C)实验组小鼠耳蜗支持细胞同时表达红色荧光蛋白、Tbx2和Atoh1后转变为vGlut3+ IHCs (黄色箭头)。(D-E)扫描电镜分析表明,与对照组相比(D),实验组小鼠(E)具有额外一排不连续的IHCs,这些IHCs顶部有纤毛形成(白色箭头)。
该工作在听觉系统发育再生研究组刘志勇研究员的指导下,由助理研究员毕政鸿、副研究员李响和博士研究生任旻蕙共同完成。博士研究生顾云鹏、研究助理朱彤、博士研究生李书亭、王广琴、孙素红、孙雨薇对课题做出了重要贡献。本研究在论文撰写过程中得到了脑智卓越中心蒲慕明研究员、杜久林研究员、何杰研究员以及北京大学于翔教授的指导。中科院脑智卓越中心电镜技术平台、光学成像平台、分子细胞技术平台以及实验动物平台(实验鼠房)予以本项目有力支持。该研究得到科技部、中国科学院、国家自然基金委员会和上海市的支持。
 附件下载:
附件下载: 