

发布时间:2024-07-17
2024年7月16日,中国科学院脑科学与智能技术卓越创新中心熊志奇团队、福建医科大学陈万金团队联合临港实验室程学文副研究员,在神经科学期刊Neuron杂志上发表题为“Astrocytes modulate brain phosphate homeostasis via polarized distribution of phosphate uptake transporter PiT2 and exporter XPR1”的研究论文,揭示了星形胶质细胞调控脑内磷酸根离子稳态和脑钙化发生发展的分子与细胞机制。
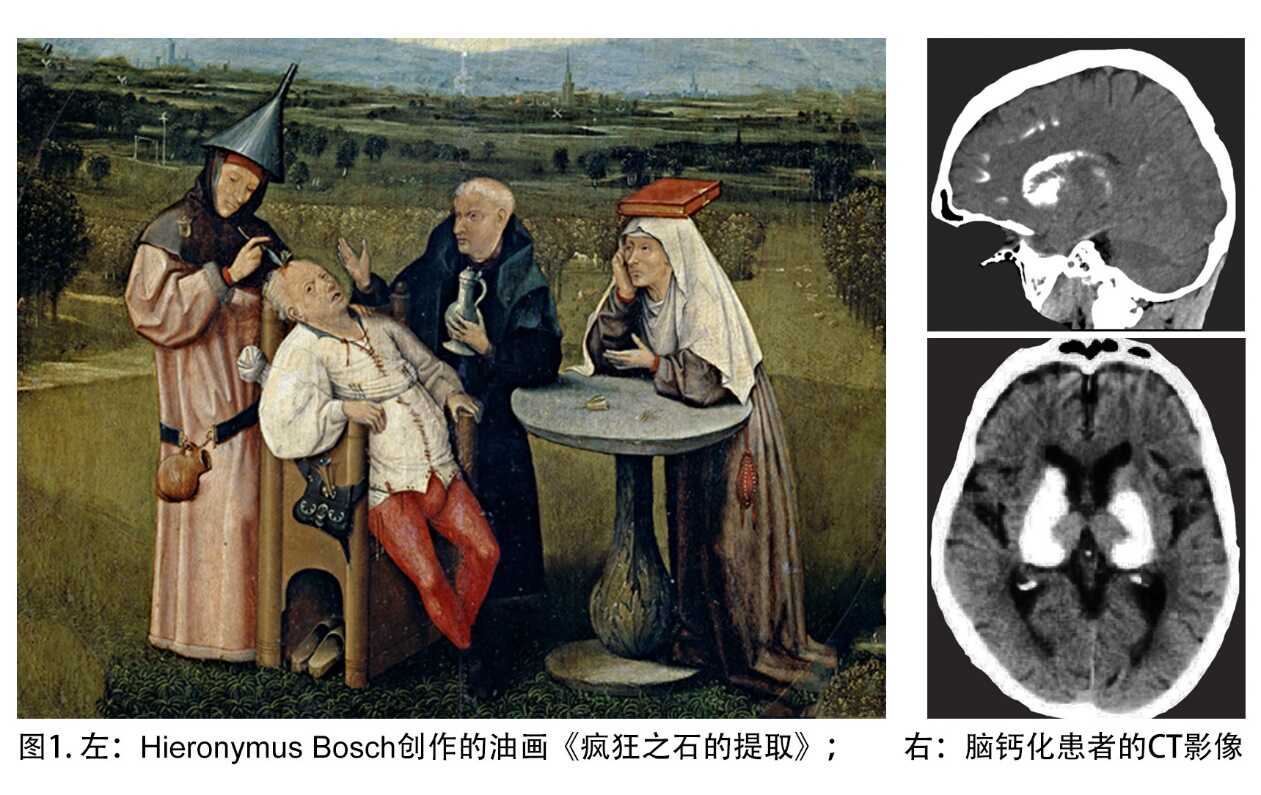
西班牙马德里的普拉多博物馆(Museo del Prado),陈列着一幅由十五世纪荷兰画家希罗尼穆斯·博斯(Hieronymus Bosch)创作的《疯狂之石的提取》(”The Extraction of the Stone of Madness”)。油画描绘了一名医生试图从患者脑中取出一块可能导致愚昧的“疯狂的石头”的场景(图1左)。1930年,德国医生Karl Theodor Fahr报道了在患有脑功能障碍的患者脑内,确实存在磷酸钙沉积形式的“疯狂的石头”(图1右)。现代医学发现脑钙化是一种非常常见的神经退行性病变,60岁以上老年人群的脑钙化发生率高达20%。由于基因突变导致的原发性基底节脑钙化,简称PFBC或者Fahr病,人群发病率近0.6%。脑钙化症的临床表现复杂,包括运动、认知和精神障碍、癫痫以及头痛等。目前没有有效防治药物。
熊志奇教授团队与陈万金教授团队长期合作,致力于神经疾病新致病基因的鉴定与功能研究。 2018年报道了脑钙化的首个隐性遗传突变致病基因MYORG,有别于其它脑钙化的致病基因,MYORG特异性表达在星形胶质细胞。星形胶质细胞参与中枢神经系统离子稳态与能量代谢的调控以及血脑屏障维持等重要功能。在人体血液中,无机磷酸根离子维持在0.8到1.5 mM之间,而在脑脊液中浓度仅为0.35到0.5 mM。另外,大脑消耗了人体20%的能量,神经活动过程的能量代谢可导致的局部无机磷酸根离子浓度升高,可能导致神经毒性和磷酸钙沉积。从脑钙化的致病基因MYORG的细胞特异性表达现象,研究人员解析了星形胶质细胞调控脑内磷酸根离子稳态以及脑钙化发生发展的分子机制。
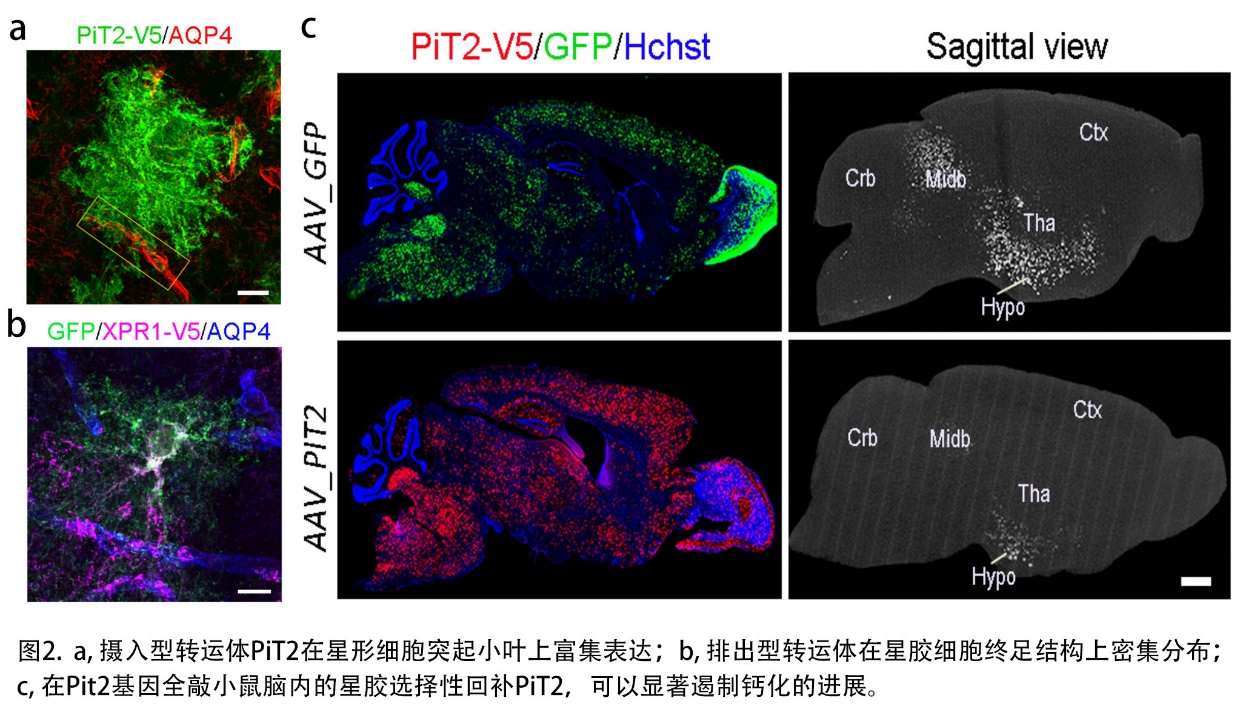
结合多种标记技术发现磷转运体基因Pit2和Xpr1在星形胶质细胞中高表达,而神经元则主要表达Pit1和Xpr1。星形胶质细胞围绕突触间隙的突起小叶(leaflet)中高表达磷转入蛋白PiT2,而包裹血管的终足(end-feet)结构则富集分布磷转出蛋白XPR1,这种极化的分布模式赋予了星胶细胞特殊的磷转运潜能(图2a, 2b)。星形胶质细胞中特异性敲除编码磷酸根离子摄入型转运体的Pit2基因,或者编码磷酸根转出转运体的Xpr1基因,均可导致脑脊液中的磷酸根浓度显著上升,而其它类型神经细胞中的敲除对脑脊液中磷酸根浓度影响较小,证明星形胶质细胞通过PiT2和XPR1在维持脑内磷稳态中起主导作用。通过建立基于32P同位素标记的体系,发现星形胶质细胞的磷酸根离子转运能力是神经元的2.5倍。在星形胶质细胞敲除Pit2基因导致其磷摄取能力下降70%;脑钙化隐形遗传致病基因产物—MYORG,促进星形胶质的PiT2的细胞膜表达且增强其磷酸根转运能力。最后,采用可穿透血脑屏障的AAV递送体系,在Pit2基因全身敲除的动物模型上特异性地在星形胶质细胞中回补PiT2表达,发现Pit2全敲小鼠的脑脊液磷酸根离子水平明显降低,脑内的钙化沉积也得到显著改善(图2c),有望为脑钙化患者提供一种基于病因修复的新型基因疗法。
磷是生命重要的元素,人体的血液中磷酸根离子水平的异常可引发严重疾病。血磷水平的升高导致血管和心脏瓣膜钙化可造成心血管功能障碍并危及生命。有科学家发现动物血液中磷酸根离子浓度的高低与不同物种的平均寿命呈线性负相关。本研究揭示了星形胶质细胞调控脑内磷酸根离子稳态的分子机制 (图3),同时发现脑钙化的发生与星形胶质细胞之间的直接而重要的病理机制关系。此项基础科学家与临床专家的合作研究成果为理解衰老和神经退行性病变的代谢机制、新型研发措施干预开启了新的方向。

该文章的共同第一作者为临港实验室程学文博士、福建医科大学第一医院赵淼博士、临港实验室陈蕾博士、中国科学院脑科学与智能技术卓越创新中心黄晨伟。熊志奇研究员、陈万金教授、程学文副研究员为共同通迅作者。中国科学院脑科学与智能技术卓越创新中心蒲慕明研究员、竺淑佳研究员、刘静宇研究员和周嘉伟研究员,北京脑科学与类脑研究中心戈鹉平研究员,上海交通大学精神卫生中心朱永川教授为该研究提供了大力支持和指导。相关研究组的同学与同事,单位平台与工作人员提供了重要支持。本项目受到国家科技创新2030重大项目、国家自然科学基金委、上海市、临港实验室和福建省科委的经费资助。
 附件下载:
附件下载: 