2021年8月17日,中国科学院脑科学与智能技术卓越创新中心、神经科学国家重点实验室、上海脑科学与类脑研究中心杨辉研究组Protein & Cell上发表了题为“ Precise Genome Editing without Exogenous Donor DNA via Retron Editing System in Human Cells”的研究论文,该研究进一步优化了Retron系统,首次证明了Retron系统在哺乳动物细胞中的可适用性,对于该系统在高等真核生物细胞中的进一步应用具有重要指导意义。
细菌在与噬菌体的长期博弈中发展出了许多精妙的防御体系,其中就包括了CRISPR系统。CRISPR-Cas系统的出现极大地推动了精准基因组编辑的发展。CRISPR-Cas9引起的DNA双链断裂 (DSB)主要由非同源末端连接途径 (NHEJ)而不是同源重组修复途径 (HDR)介导修复。研究发现使用单链DNA作为模板、提高Cas9诱导的DSB位点附近的模板DNA浓度,可以有效提高HDR的效率。近来发现Retron系统也在细菌防御噬菌体中发挥重要作用。2018年,斯坦福大学Hunter Fraser研究组的研究人员开发的CRISPEY巧妙地将Retron系统与CRIPSR系统结合,通过Retron系统在细胞内逆转录产生单链供体模板DNA, 并且将其与sgRNA共价偶联。在酵母细胞中,CRISPEY可以在酵母细胞中高效精确地(>80%编辑效率)敲入长达700bp的DNA序列。但是,Retron系统在哺乳动物细胞是否可以工作一直没有研究。
中科院脑智卓越中心杨辉研究组通过将四种已被报道具有功能的retron系统 (Ec48、Ec73、Ec86和Ec107) 在哺乳动物细胞内的表达,证明了细菌retron系统能在哺乳动物细胞中逆转录产生单链DNA。通过将retron RT融合于Cas9蛋白的N端或C端 (RT-Cas9 or Cas9-RT),以及将retron ncRNA连接于sgRNA的5’端或3’端 (5’ rgRNA or 3’ rgRNA),研究人员发现Cas9-Ec73RT和3’ Ec73 rgRNA的组合能最有效的在哺乳动物细胞内完成精准DNA编辑 (~10%编辑效率)。该研究初步探索了Retron editing在哺乳动物细胞中的应用, 验证了Retron Editing用于哺乳动物细胞精准基因编辑的可行性。
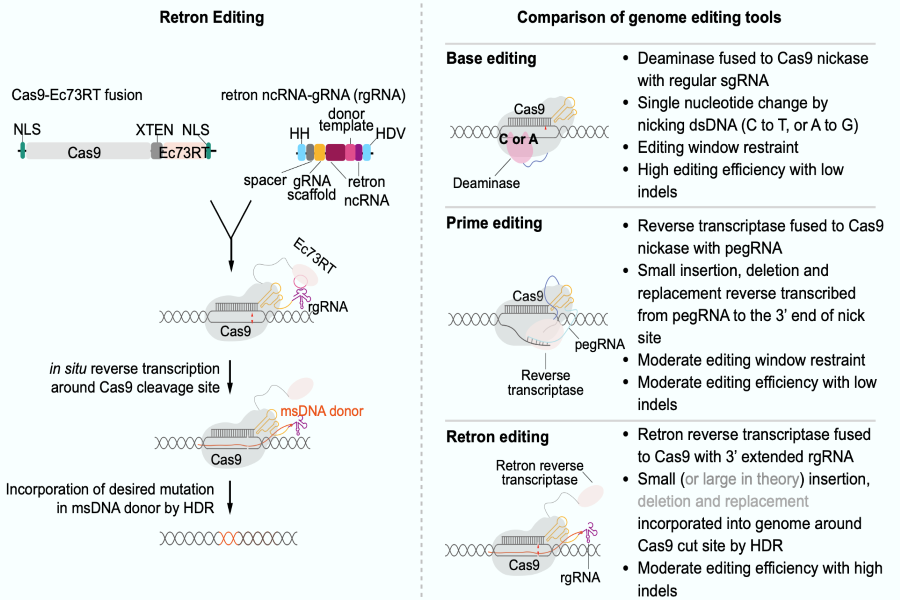
图2 Retron Editing工作示意图及其与DNA碱基编辑器、Prime editing的比较
相较于目前比较常用的DNA单碱基编辑及Prime editing,依赖HDR机制的Retron editing相对受到PAM位置限制比较小;并且,Retron editing系统不需要额外提供外源供体模板DNA。另外,目前在植物细胞中由于HDR效率低及外源同源重组供体模板DNA递送困难等原因造成基因 (尤其是长片段) 敲入的效率较低,不需要提供外源供体模板DNA的Retron editing系统也许能为植物基因组编辑提供一个新的选择。因此,Retron editing应用于基因组编辑有其特有的优势,值得后续更多的优化升级工作,以期早日将Retron editing系统应用于脑疾病治疗及作物性状改良等领域。
该研究由中科院脑智卓越中心汪子康博士、张仁霞博士研究生和辉大生物科技有限公司孔祥锋博士等在杨辉研究员的指导下完成。中科院脑智卓越中心周英思博士、辉大生物科技有限公司施霖宇博士、王兴博士对该研究做出了重要贡献。




 附件下载:
附件下载: 