

发布时间:2021-03-09
2021年2月8日,《Development》期刊在线发表了中科院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心、神经科学国家重点实验室刘志勇研究组题为《嵌合CRISPR-stop技术实现核心基因突变的快速表型分析》的研究论文。
小鼠和人类的听觉系统在发育和功能上十分相似,因此,利用小鼠模型筛查耳蜗听觉毛细胞发育过程中的重要基因对于毛细胞再生和临床上寻找耳聋基因的治疗靶点有重要的意义。虽然目前耳蜗毛细胞在幼年和成年不同发育时期的转录组分析已有报道,但是至今为止,我们对于毛细胞分化成熟的分子机制还知之甚少。其中一个主要的原因是因为传统的小鼠模型构建费时费力,通常需要首先构建F0代小鼠,然后进行生殖细胞传代,获得遗传稳定的F1小鼠之后再进行后续的实验。
为了快速进行突变基因的表型筛查,刘志勇研究组于2018年建立了直接在F0代小鼠中同时敲除三个非致死基因的方法。但是,小鼠约25%的基因纯合突变会导致早期胚胎流产或者出生后致死,导致之前的策略并不适用致死基因的突变筛查。解决这个问题的常规策略是利用Cre/Loxp系统进行条件性基因突变,但是更加费时费力。
如何加速致死基因的表型分析呢?本研究首次尝试在小鼠2细胞期卵裂球的1个细胞内注射单碱基编辑元件和基因特异性的sgRNA,产生嵌合体突变的小鼠,即在该小鼠各个器官内,野生型(没有基因编辑的细胞后代)和纯合突变型(经过基因编辑的细胞后代)的细胞交错分布,这种方法因此被命名为MosaicCRISPR-stop。
该研究首先利用Atoh1基因来检测方法的可行性。Atoh1 -/- 小鼠不能产生耳蜗毛细胞且出生后由于呼吸节律紊乱而致死。结果显示,利用Mosaic CRISPR-stop方法产生的Atoh1突变小鼠的耳蜗毛细胞数量显著减少且该小鼠可以存活到成年。
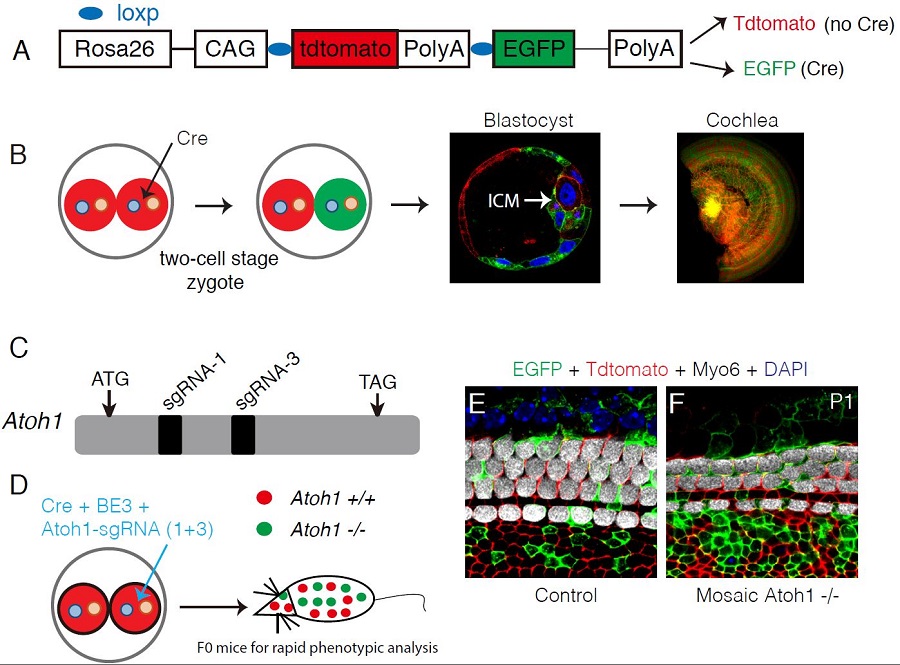
图1: 利用Atoh1验证嵌合型突变方法的可靠性。(A)双报告基因小鼠的模式图。没有cre表达时,所有细胞表达红色蛋白。反之,有cre表达时,细胞关闭红色,开始表达绿色蛋白。(B)二细胞期受精卵的一个细胞注射cre, 内生细胞团(inner cell mass,ICM)和耳蜗(cochlea)同时含有绿色和红色的细胞。(C)Atoh1基因两个高效的sgRNA(1+3)的位置示意图。(D)在二细胞期受精卵的一个细胞内注射cre, 单碱基编辑系统 (BE3) 和 2个针对Atoh1基因的sgRNA(1+3), 直接产生的F0小鼠是嵌合型纯合突变,可以用于快速的表型分析。(E-F) 相对于对照组(E), 嵌合型纯合突变小鼠耳蜗的毛细胞数量显著减少。
随后,致死基因Sox10突变耳蜗长度缩短的表型也可以被Mosaic CRISPR-stop方法重现。
最后,该研究利用此方法探索了Rbm24基因(其突变导致心脏异常和胚胎期死亡)的功能。Rbm24在耳蜗毛细胞高峰度表达,但其功能还完全未知。
利用Mosaic CRISPR-stop方法,作者在8周内快速鉴定出了Rbm24 -/-嵌合小鼠耳蜗的表型为毛细胞大量死亡,这表明Rbm24对于毛细胞的存活发挥了重要的功能。这个表型也可以被传统的Rbm24条件性敲除小鼠模型所重复。
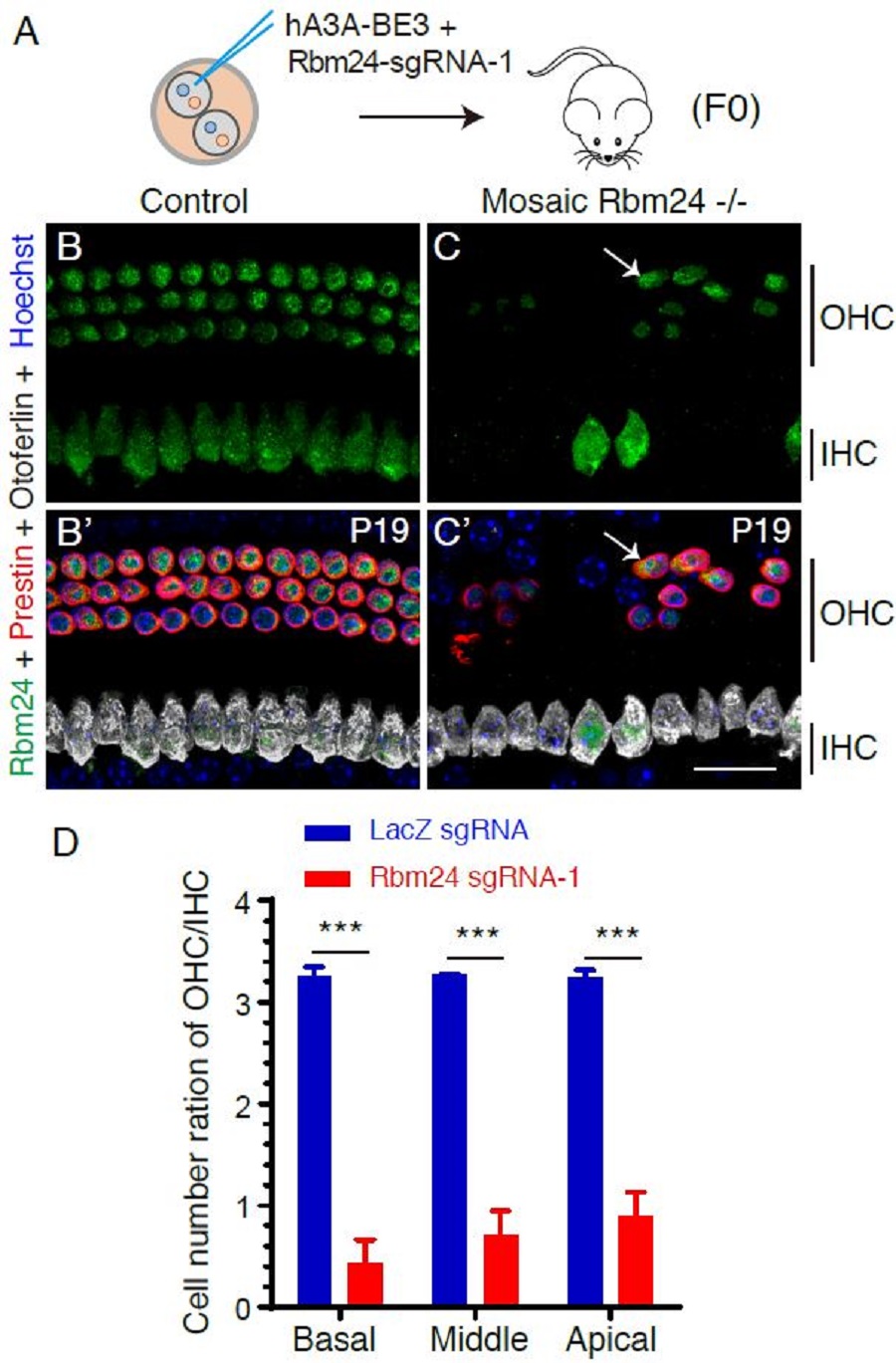
图2: 利用嵌合型突变方法快速鉴定出Rbm24是维持耳蜗外毛细胞存活的重要基因之一。(A)二细胞期受精卵的其中一个细胞注射更新版本的单碱基编辑系统(hA3A-BE3) 和 Rbm24特异的sgRNA-1,直接产生的嵌合型纯合突变F0小鼠可以立即用于表型分析。(B-C’) 相对于对照组 (B 和B‘), 嵌合型纯合突变耳蜗(C和C’) 的外毛细胞大量死亡。白色箭头所示是残留的、依然表达Rbm24的外毛细胞(Prestin+)。(D) 跟注射LacZ sgRNA (蓝色)的对照组相比,实验组(红色)的外毛细胞数量显著降低。
值得强调的是:Mosaic CRISPR-stop研究方法不仅适用于听觉系统,也适用于其他器官组织,具有很高的普适性,可以大大加速发育神经生物学领域鉴定基因功能的速度。
该工作由中科院脑智卓越中心听觉系统发育再生研究组刘志勇研究员指导,主要由博士研究生王广琴与博士后李超共同完成,研究组的贺顺姬也做出了重要贡献。该研究中的共聚焦成像相关工作在中科院脑智卓越中心所级中心的光学成像平台完成,杨辉研究组提供了显微注射仪器,动物房刘倩在胚胎移植实验中提供了很大帮助。本工作得到中科院、科技部、基金委的基金资助。
论文链接:https://dev.biologists.org/content/early/2021/02/05/dev.196899
 附件下载:
附件下载: 