流金岁月
自噬调控神经元轴突发育的新机制
8月19日,国际细胞自噬领域的核心期刊《自噬》在线发表了题为《Mir505-3p通过调控Atg12及自噬通路以影响神经元轴突发育》的研究论文。该研究由东华大学化工生物学院周宇荀团队与中科院神经科学研究所、脑科学与智能技术卓越创新中心仇子龙研究组合作完成。该研究利用CRISPR/Cas9系统构建了Mir505基因敲除小鼠,结合胚胎电转技术和透射电镜技术,报道了Mir505-3p基因通过靶向抑制自噬相关基因Atg12,负向调控自噬通路并促进神经元轴突发育的新功能。该研究提供了自噬对神经发育调控作用的新证据。
“自噬”即“自我吞噬”,是一种将体内衰老细胞器和包浆中内含物包裹、降解并得以循环利用的生理途径。自噬最显著的特点是需要合成名叫“自噬小体”的多层膜结构,在这种膜结构的包裹和呈递下,内含物进入溶酶体系统并得以降解。尽管从上世纪七十年代起,神经元已是最早一批用来观察和鉴定细胞自噬超微结构的细胞之一,但是细胞自噬是如何广泛地影响神经系统发育、神经退行性病变发生,以及如何调控轴突损伤后再生却缺乏详尽研究。近年来,关于神经系统中细胞自噬的基础与临床研究以及自噬通路关键基因动物模型的研究已成为目前医学与神经系统疾病相关领域的重要课题。
东华大学周宇荀团队在之前的研究中发现了一个与小鼠性发育相关的数量性状座位(图A),并且发现Mir505基因是潜在的调控者。另一项针对人X染色体连锁的垂体发育不良症的研究表明,Mir505同样位于调控该疾病的数量性状座位上(图B)。由于哺乳动物性发育和垂体发育的本质都是神经系统的发育,因此,东华大学的研究者们试图在神经系统中考察Mir505基因是否影响神经发育事件,并由此展开了与中科院神经科学研究所仇子龙研究组的课题合作。
研究者首先利用体外培养的皮层神经元模型验证Mir505基因是否参与调控神经元发育。研究发现,Mir505基因的一个成熟体Mir505-3p特异性促进神经元极性建立、轴突生长和轴突分支,但是不影响树突发育;而另一个Mir505基因的成熟体则不具备这一功能。研究者们利用胚胎电转技术在小鼠体内皮层组织中观察到了同样表型。利用双荧光素酶报告系统并结合生物信息学预测、神经元转录组测序数据,研究者在神经元中筛选出Mir505-3p的靶基因为自噬相关基因Atg12。Atg12是细胞自噬通路上一个关键基因,其编码的ATG12蛋白分子与ATG5蛋白和ATG16L1蛋白形成复合物,调控自噬小体早期形成和延伸。在本项研究之前,Atg12是否参与调控神经系统发育事件并不清楚。
为了研究Atg12对于神经元形态发育的功能,研究者们在体外培养的小鼠皮层神经元中分别运用脂质体转染和电穿孔转染两种方式过表达Mir505-3p以及Atg12,发现Atg12显著抑制神经元极性建立、轴突生长以及轴突分支,这些现象与Mir505-3p展现的功能相反。并且,共转Mir505-3p可以恢复Atg12对于神经元轴突发育的抑制效果(图C),这初步证实了Atg12抑制体外神经元轴突发育的现象。接下来,研究者们利用胚胎电转技术观察到,过表达Atg12可以恢复Mir505-3p对于体内同侧皮层和对侧皮层神经元轴突生长和分支的促进效果(图D),进一步证实了Atg12抑制体内神经元轴突发育的现象。
为了进一步研究Mir505-3p对于小鼠神经元轴突发育是否必需,研究者们利用CRISPR/Cas9系统构建了Mir505基因特异性敲除的基因工程小鼠。通过HE染色、甲苯胺蓝染色(图E)以及免疫荧光染色(图G),研究者们观察到Mir505敲除小鼠在胼胝体、扣带皮层和海马伞等轴突富集区域信号减弱,但是扣带皮层处的成熟神经元数目没有显著变化(图G)。这提示,Mir505基因敲除小鼠轴突信号减弱的原因并不是神经元前体细胞增殖受干扰,而是因为Mir505-3p对于小鼠轴突正常发育是必需的。利用这一小鼠模型,研究者们在透射电镜下观察到,在Mir505敲除小鼠体外培养的皮层神经元和小鼠皮层组织中(图F)自噬小体发生显著变化。基因敲除小鼠的自噬小体数目和面积显著增加,而线粒体数目显著减少。这表明,Mir505-3p对于维持神经系统正常自噬信号是必需的,敲除Mir505基因引起神经系统中自噬通路整体激活。研究表明,轴突发育过程涉及细胞微管系统骨架蛋白重排、膜蛋白以及众多极性蛋白分子的合成与转运,这些事件的发生均依赖于神经元充足的能量供给,因此,轴突局部的线粒体分布和线粒体移动性对于轴突生长和分支至关重要。Mir505基因敲除小鼠神经元胞体和轴突局部自噬小体增多并伴随线粒体数目减少,进一步提示Mir505-3p最终通过自噬通路调控轴突局部线粒体分布以影响神经元轴突发育。随后,研究者在原代培养的MEF细胞中证实,Mir505-3p通过抑制Atg12广泛影响着细胞自噬通路以及线粒体数目。
此工作利用神经元体外培养模型、体内胚胎电转技术、电镜技术和基因工程小鼠模型共同鉴定了Mir505-3p调控神经元轴突发育的表型,报道了Mir505-3p在神经系统中的靶基因是自噬相关基因Atg12,突出了microRNA和细胞自噬对于神经元轴突发育的关键作用,提出了Mir505-3p通过调控Atg12/自噬通路以影响轴突局部线粒体分布的全新信号通路及其分子机制(图H),对深入理解自噬通路对神经系统发育的调控有重要意义。
该项工作由东华大学博士研究生、现中科院神经科学研究所博士后杨侃在东华大学周宇荀副教授和神经科学研究所仇子龙研究员的共同指导下完成,仇子龙课题组的其他成员俞彬、程诚、程田林、袁博积极参与,并得到了组内张月芳、单仕芳的技术支持,以及神经所共聚焦显微镜平台胡谦、向丹、陈旭鑫,干细胞平台张敏、钱嵩林、姜维芳,动物房平台韩玲和电镜成像平台孔妤、潘立君、张宾、王旭的大力协助,是两个课题组、众多实验平台技术人员通力合作的研究成果。本工作得到科技部973项目、基金委重大研究计划培育项目、中科院战略性先导科技专项、国家自然科学基金、上海市科委重点项目、东华研究生创新基金的共同资助。
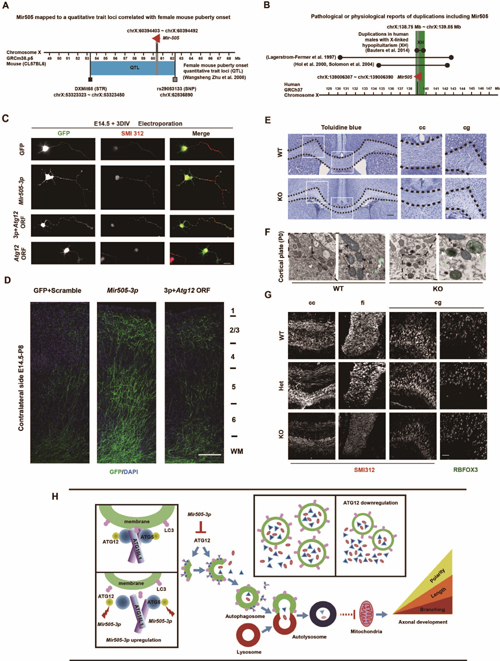
图注 (A)Mir505基因位于一个调控雌鼠性发育的数量性状座位上。(B)Mir505基因位于一个影响人类X染色体连锁的垂体发育不良症的数量性状座位上。(C)在体外培养的小鼠皮层神经元中,Mir505-3p通过抑制Atg12调控神经元极性建立、轴突生长和轴突分支。(D)体内胚胎电转结果显示,Mir505-3p通过抑制Atg12促进皮层神经元在对侧脑室轴突生长和轴突分支。(E)甲苯胺蓝染色指示Mir505敲除小鼠胼胝体处轴突发育异常。(F)透射电镜结果显示,Mir505敲除小鼠皮层脑组织中自噬小体数目和面积增加,线粒体数目减少。F图中绿色伪彩指示自噬小体,蓝色伪彩指示线粒体。(G)免疫荧光染色指示Mir505敲除小鼠的胼胝体、扣带皮层和海马伞处轴突发育异常,但扣带皮层处成熟神经元数目正常。(H) Mir505-3p通过Atg12/自噬通路调控神经元轴突发育的机制图。
论文链接:http://dx.doi.org/10.1080/15548627.2017.1353841
(审稿:罗振革、姚海珊)


