流金岁月
应用优化的CRISPR技术建立基因完全敲除的小鼠及猴
6月6日,《细胞研究》在线发表了一项成果,应用改进的“C-CRISPR”技术可以获得单基因或多基因功能完全敲除的小鼠及猴。这项研究由中科院神经科学研究所、脑科学与智能技术卓越创新中心的杨辉研究组、熊志奇研究组以及神经所苏州非人灵长类研究平台孙强团队合作完成。该研究通过将多个针对基因外显子的连续指导RNA(sgRNA)注射到受精卵中,可以高通量制作各种基因完全敲除小鼠并用于表型分析,并快速制作基因敲除猴模型。
CRISPR/Cas9系统是一种非常高效的基因编辑方法,但是大部分被基因编辑过的动物都有嵌合性,也就是说它们只有一部分细胞的基因发生了编辑。对于涉及表型的研究而言,嵌合的基因编辑动物需要进一步地杂交育种,才能得到完全的基因敲除动物。当涉及大型动物,比方说非人灵长类时,嵌合体的问题就会显得尤为严重,因为猕猴的繁殖周期长达5-6年而且每胎只生一个幼崽。之前有许多研究者都试图一步法来产生没有嵌合的基因修饰动物,尤其是大型动物。包括将Cas9 mRNA和sgRNA注射到卵母细胞中而非受精卵中,或注射Cas9蛋白,或注射双sgRNA。但是DNA测序分析了这些方法的动物个体组织后,发现这些方法完全做到双等位基因敲除的效率相当低。
这项研究中,研究者发现向受精卵当中注射Cas9 mRNA和多个sgRNA的鸡尾酒式混合物,单个或多个基因在小鼠胚胎能做到100%的完全删除,以及猴子胚胎中91%-100%的删除。这种方法能同时产生插入缺失和外显子删除,从而实现高效的基因完全敲除。研究者还应用C-CRISPR法建立基因功能完全敲除的F0代小鼠,用于基因功能的快速表型分析,以及获得基因功能完全敲除的F0代猴。最后,通过高通量测序分析显示,C-CRISPR在基因编辑过的小鼠和猴子中不会引入明显的脱靶改变。
该项工作由博士后左二伟,助理研究员蔡毅君,博士后李奎,研究生魏瑜,博士后王邦安在灵长类疾病模型研究组杨辉研究员、疾病神经生物学研究组熊志奇研究员与苏州非人灵长类研究平台主任孙强博士的指导下完成,课题组的其他成员积极参与,并得到了生化细胞所李劲松研究员、徐国良研究员的大力协助,是众多课题组通力合作的重要成果。
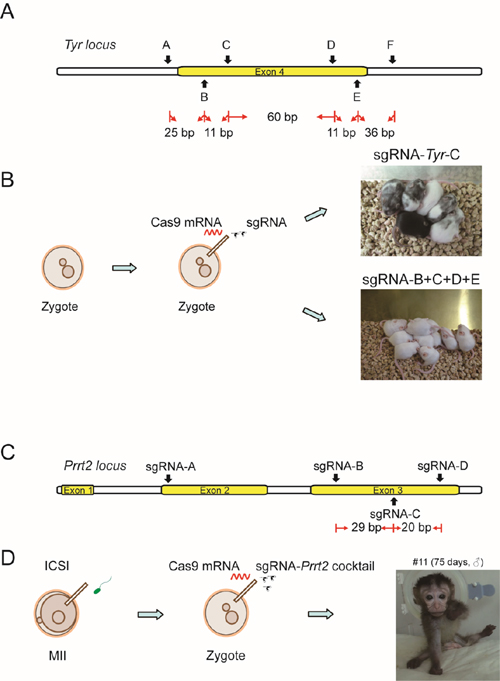
一步法获得基因完全敲除的小鼠和食蟹猴:A. 小鼠Tyr基因sgRNA靶向位点示意图。B.注射Cas9 mRNA合并多个毗邻的sgRNA进入小鼠受精卵。C.食蟹猴Prrt2基因sgRNA靶向位点示意图。 D.MII卵子单精子注射发育到原核期受精卵, 随后注射Cas9 mRNA合并多个毗邻的sgRNA。


