流金岁月
TRPC6特异抑制β淀粉样蛋白的形成
11月19日,Nature Communications 期刊在线发表了中科院上海生命科学研究院神经科学研究所神经信号转导实验室的研究论文:“TRPC6 specifically interacts with APP to inhibit its cleavage by γ-secretase and reduce Aβ production” 。该研究发现TRPC6阻碍底物APP与γ分泌酶的结合,特异抑制β淀粉样蛋白(Aβ)的形成,这为减少Aβ产生进而治疗阿尔海默症(AD)提供了新的思路。
阿尔海默症是患病人数最多的神经退行性疾病之一,是导致老年人群痴呆的首要因素。β淀粉样蛋白的过度产生和积累是AD重要的病理变化,因此阻断γ分泌酶切割APP形成Aβ是治疗AD的一种可能方式。然而现有抑制剂在阻断γ分泌酶切割APP的同时,也阻断了其切割其他底物,故γ分泌酶抑制剂的临床试验产生非常严重的毒副作用。如何实现特异抑制γ分泌酶对APP的切割,但不影响其整体活性,是目前领域内亟待解决的重要问题。
神经所神经信号转导实验室的研究发现TRPC6与APP结合,阻止γ分泌酶结合并切割底物C99,减少Aβ产生。TRPC6不抑制γ分泌酶的整体活性,不影响Notch,E-/N-Cadherin等γ分泌酶切割其他底物。源自TRPC6的短肽也可抑制γ分泌酶切割APP产生Aβ,而不影响Notch的切割。因此通过阻碍γ分泌酶与底物APP的结合可能成为治疗AD的一种新方法,寻找发挥类似TRPC6或其短肽功能的分子有望成为治疗AD的新方案。
该课题主要由中科院神经所王军锋博士、路睿博士生以及首都医科大学的杨健博士在王以政研究员和王晓明教授的指导下完成。课题受科技部973项目、国家自然科学基金的支持。
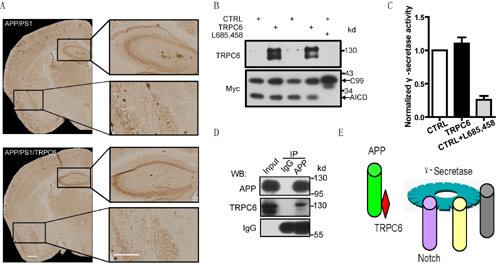
图注:A,相比于APP/PS1小鼠,APP/PS1/TRPC6小鼠有较少的老年斑沉积。B,TRPC6可抑制γ分泌酶切割C99产生AICD。C,TRPC6不影响γ分泌酶的整体活性。D,TRPC6与APP相互结合。E,模式图:TRPC6通过与APP结合,阻碍了γ分泌酶的切割。与此同时不影响γ分泌酶切割其他底物,例如Notch等。


